背景介绍
双酚是生产聚碳酸酯和环氧树脂等材料时使用的一大类化学品。其中,应用最广泛的双酚A(BPA)被公认为内分泌干扰物之一,具有体内、外毒性。它的类似物(如BPB、BPC、BPM、BPP、BPZ和BPAP,统称BPs)也会对健康产生负面影响。血清白蛋白(Serum Albumin,SA)是循环系统中最主要的载体蛋白之一,具有结合和运输内源性与外源性物质到细胞和靶组织的功能。BPs进入血液后与SA结合,会引起蛋白质的结构变化,影响蛋白质的正常功能和生物活性,产生毒性反应。其结合亲和力影响着它在体内的代谢过程。

研究简述
渤海大学化学与化学工程团队以牛的血清白蛋白(Bovine Serum Albumin,BSA)为模型转运蛋白,采用实验结合分子对接的方法,开展了双酚类似物(BPs)与牛血清白蛋白(BSA)的相互作用机制研究,深入探究了BPs在血液转运过程中对载体蛋白的蛋白质构象的影响。本研究在环境毒理学和临床医学领域具有重要意义。
研究者首先采用多光谱分析实验发现BPs相较于BPA对BSA具有更强的亲和力,并能引起更大的BSA构象变化。BPs之间具有相同的骨架结构(双酚),因此它们与BSA相互作用时所表现出的结合力、自发结合反应、结合位点数和构象变化等方面都具有相似性。不同之处在于,这些BP之间的结构差异影响了它们与BSA的疏水结合过程和牛血清白蛋白的二级结构和微环境极性。根据这些发现,研究者推断BPs-BSA的结合亲和力和BPs分子间的结构差异是影响结合过程和BSA构象变化的主要因素,这对于了解BPs在血液转运过程中分布、扩散和代谢非常重要。
计算与结果分析
为进一步了解BPs与BSA的相互作用机制,研究者采用殷赋云平台(https://cloud.yinfotek.com/) 分子对接方案模拟了BPs的分子结构,预测出它们与BSA的结合亲和力和主要结合部位。
操作简述
准备配体分子:绘制BPs的化学结构,在MMFF94力场中能量最小化,获得三维结构;
准备受体蛋白:输入BSA的PDB编号(4F5S),修复残基问题,获得三维结构;
用晶体配体来定义结合口袋;
用DOCK6.9执行半柔性对接;
通过网格评分功能对输出姿势进行评估。
下图左侧显示了BSA的两个结合位点,右侧展示了BPs和BSA结合时的最佳构象。BPs的亲脂性使它们更容易与BSA疏水空腔结合,由此推断BPs与BSA疏水口袋的结合程度与其亲脂性密切相关。配体与受体之间主要结合力为疏水相互作用,这与实验部分的结果一致。

在位点I,有BPA/BPAP/BPM/BPP/BPZ/DES/DS与BSA结合。如下图所示,BPZ与BSA的His 241残基形成氢键作用。BPAP与Aarg 217和Arg 194残基产生π-阳离子相互作用,因此可以克服苯环的空间位阻,具有很强的结合亲和力。DS与Arg 198残基具有π-阳离子相互作用(而DES没有),这解释了DS和DES具有相似的结构,但DS与牛血清白蛋白的结合亲和力高于DES与牛血清白蛋白的结合亲和力。
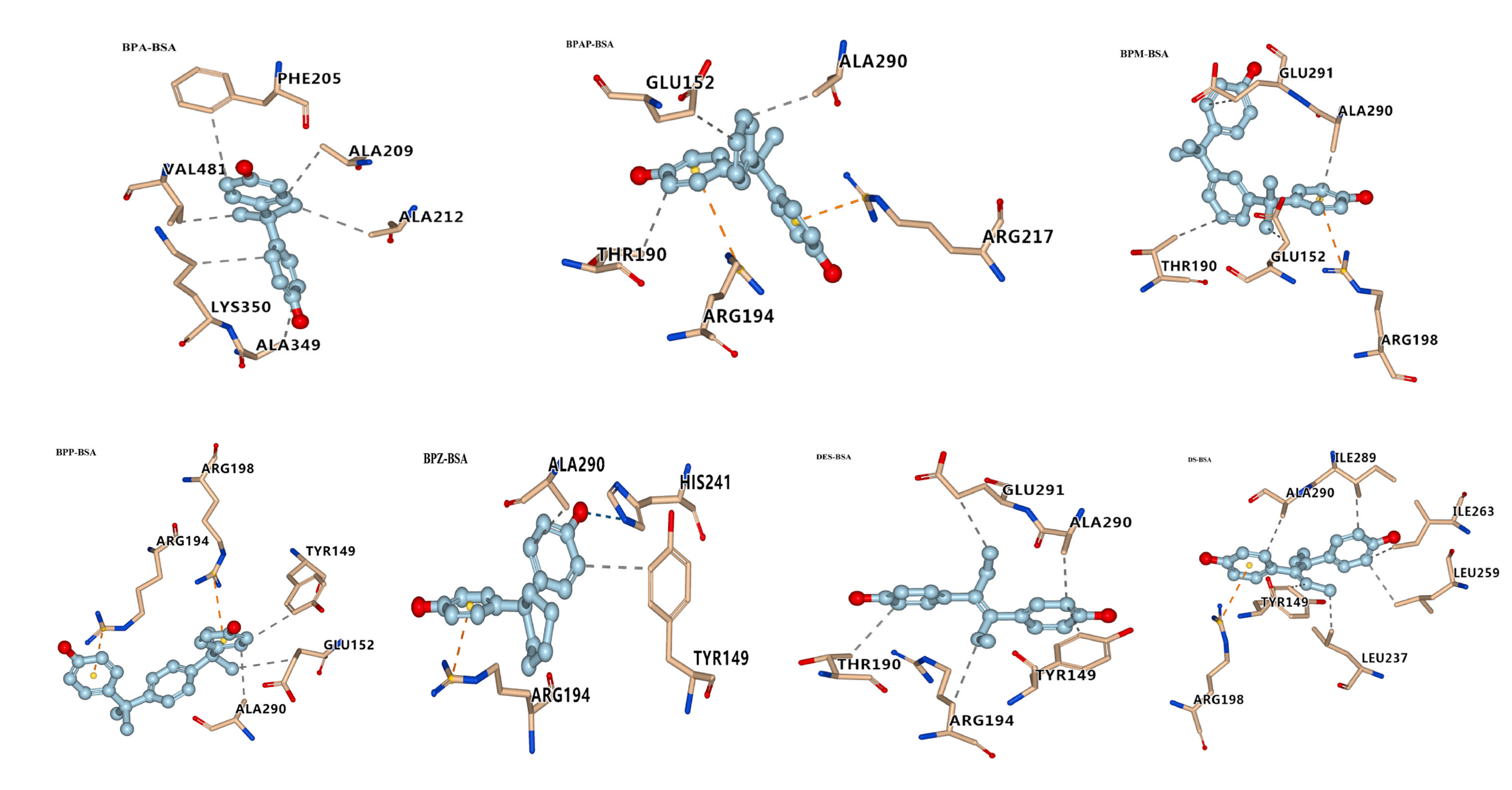
在位点II,有BPB/BPC与BSA结合,BPC与BSA的Asn 390残基形成氢键,这解释了它们结合亲和力强的原因。

从上述研究结果,我们可以看到分子对接方法能够预测出配体分子(双酚A类似物BPs)与靶标(牛血清白蛋白BSA)的可能结合构象,直观地描绘出配体与靶标口袋内残基的相互作用细节,进而阐明它们的相互作用机制,为后期进行新型双酚结构优化打下基础。
案例总结
本研究通过研究BPs和BSA的构效关系,深入探讨了两者之间的结合机制,实验和计算模拟结果相得益彰,为新型双酚的应用研发和潜在内分泌细胞的识别提供了参考,在环境毒理学和临床医学领域具有重要意义。该成果已经发表在学术期刊Chemosphere上。
REFERENCE
Gu J, Huang X, Liu H, Dong D, Sun X. A mutispectroscopic study on the structure-affinity relationship of the interactions of bisphenol analogues with bovine serum albumin. Chemosphere. 2022 Mar;291(Pt1):132769.
