本期分子模拟亮点:
研究人员依据分子对接打分调整了对接策略,通过三聚体而非单体的结合方式完美解释了实验结果。
研究人员运用分子动力学模拟,通过均方根偏差(RMSD)、均方根波动(RMSF)、旋转半径(RG)和结合自由能等指标分析了研究体系的动态稳定性、结构变化和相互作用力,解释了酚类物质抑制酶活性的作用机制。
背景介绍
全谷物麸层中的结合态酚类物质具有抗氧化活性高、生物活性强的特点,是全谷物的功能成分。α-葡萄糖苷酶是一种位于小肠上皮细胞刷状边缘的寡糖水解酶,负责将低聚糖和双糖水解成单糖。糙米膳食纤维中释放的结合酚类化合物已被证明具有很强的α-葡萄糖苷酶抑制活性,可以改善糖代谢和胰岛素抵抗,有益人类健康。
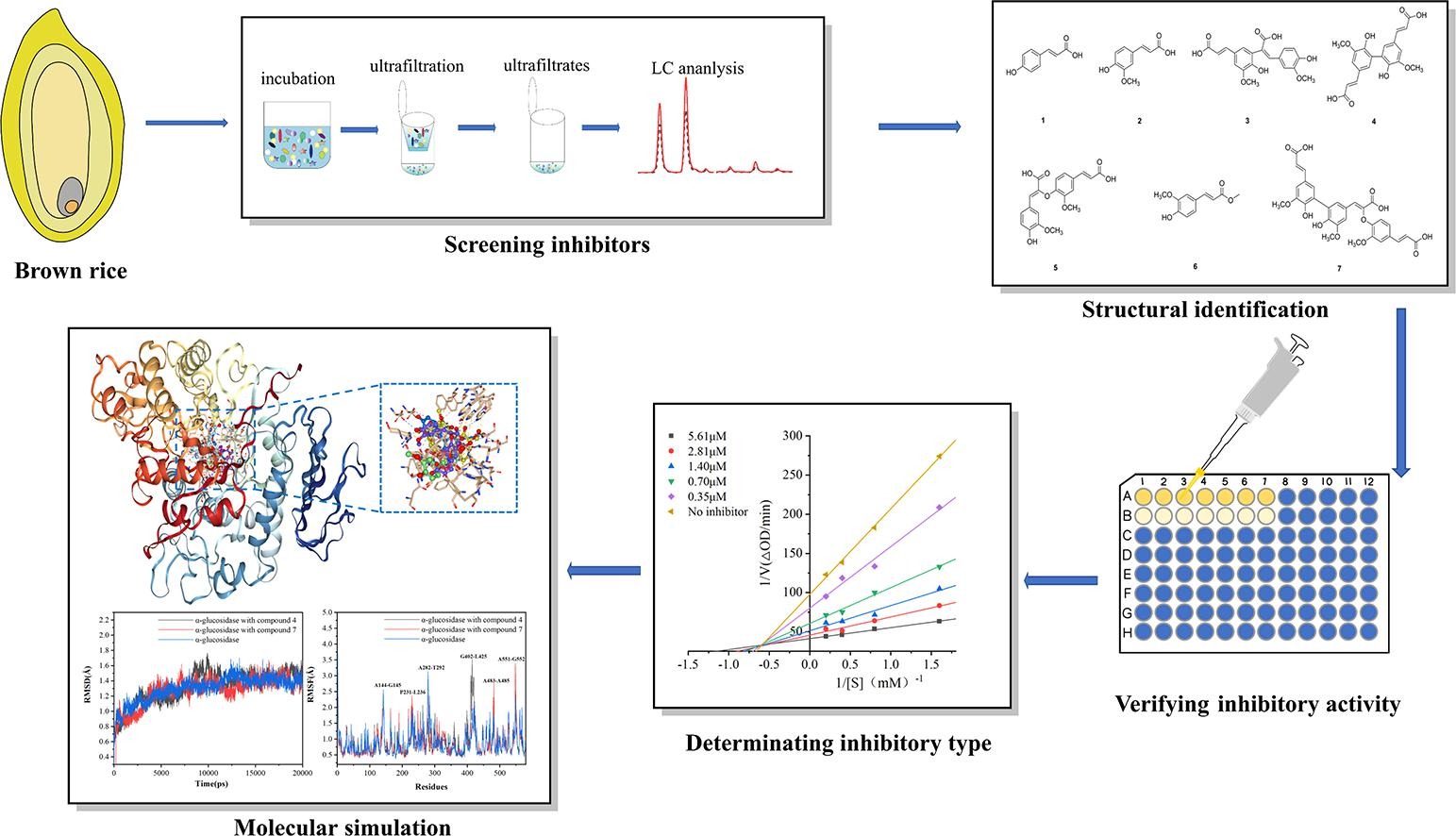
研究简述
广东省农业科学院农业食品研究团队应用亲和超滤技术从糙米结合态酚类物质提取物(BRBPE)中筛选出新的生物活性配体,通过酶动力学、分子对接和分子动力学分析,揭示了结合态酚类物质在体外对α-葡萄糖苷酶的抑制机制。本研究为开发与糙米结合的;酚类降血糖药物提供了理论依据,同时也为提高糙米对人类健康的利用提供了有用的信息。
研究人员采用亲和超滤结合高效液相色谱法从糙米结合态酚类提取物(BRBPE)鉴定出7种酚类化合物:3种单体(对香豆酸、阿魏酸、阿魏酸甲酯)、3种二聚体(8-5’、5-5’、8-O-4’二阿魏酸)和1种三聚体(5-5’/8-O-4’脱氢三阿魏酸)。它们对α-葡萄糖苷酶均有抑制作用,其中5-5’/8-O-4’脱氢三阿魏酸和5-5’二阿魏酸的抑制活性最好。酶动力学分析表明,这7种抑制剂的抑制机制包括竞争性、非竞争性和混合方式。
分子模拟计算方法
为了深入了解糙米结合态酚类提取物抑制α-葡萄糖苷酶活性的作用机理,研究人员采用殷赋云平台的分子对接和分子动力学方案进行计算模拟。分子对接分析表明,这7种抑制剂主要通过氢键、疏水力和离子键与α-葡萄糖苷酶结合。分子动力学模拟进一步揭示了酚类-葡萄糖苷酶复合体的结构和分子性质。这项工作为糙米结合的酚类化合物作为有效的α-葡萄糖苷酶抑制剂提供了深刻的见解。
分子对接流程简述
- 以异麦芽糖酶晶体结构(PDB ID:3aj7, 72%同源性)为模板,利用同源模建技术建立α-葡萄糖苷酶的三维结构。
- 在殷赋云平台(https://cloud.yinfotek.com/)上绘制酚类化合物的结构,通过MMFF94力场能量最小化,获得良好的三维结构。
- 采用DOCK6.9计算方案进行半柔性对接,分析结合模式。
- 通过Grid Score对输出姿势进行评估。
分子动力学流程简述
- 在殷赋云平台(https://cloud.yinfotek.com/)上使用 【处理PDB结构(进阶版)】小工具处理得到α-葡萄糖苷酶和酚类化合物的分子结构。
- 使用 **【生成Amber文件】**小工具生成复合物的拓扑文件和坐标文件。其中,使用了截角八面体OPC水模型进行溶剂化处理,添加抗衡离子中和电荷,并使用周期性边界条件(PBC)来避免边界效应。
- 经过能量最小化、加热和平衡后,进行20 ns分子动力学模拟。
- 最后对轨迹进行分析和结合自由能计算。
分子模拟结果分析
1. 分子对接
由图1a可见,化合物1-7都被对接到α-葡萄糖苷酶的活性口袋中。分子对接打分(Grid Score)代表配体与酶的结合亲和力,分数越低,结合作用越强。打分细节包括范德华力和静电力贡献。
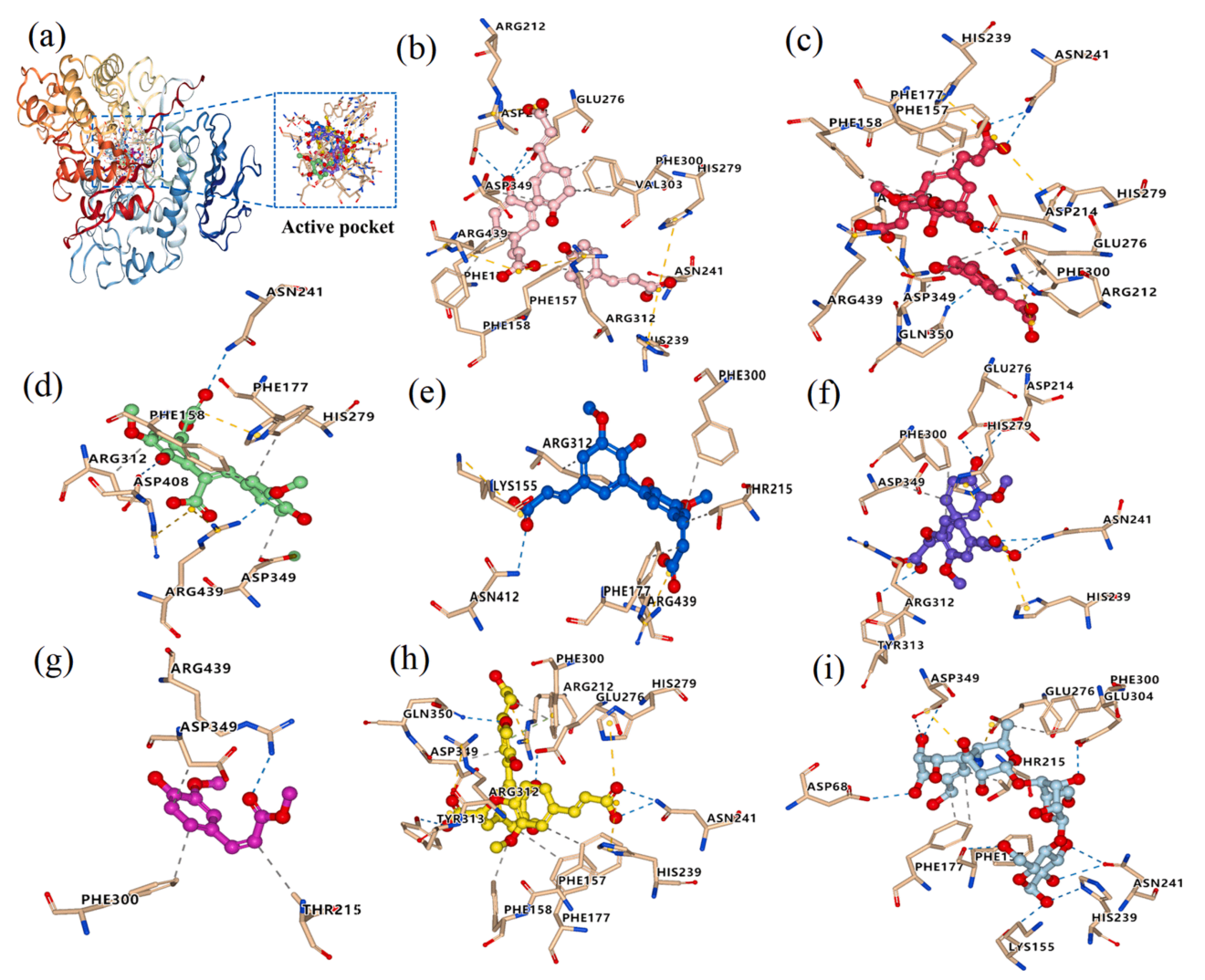
上述七种化合物的范德华作用力的打分都远远低于静电力,这表明范德华作用力(主要为疏水作用)是两者结合过程中的主要相互作用(表1)。这部分结果与文献一致,疏水相互作用是酚类和蛋白质相互作用的主要驱动力。
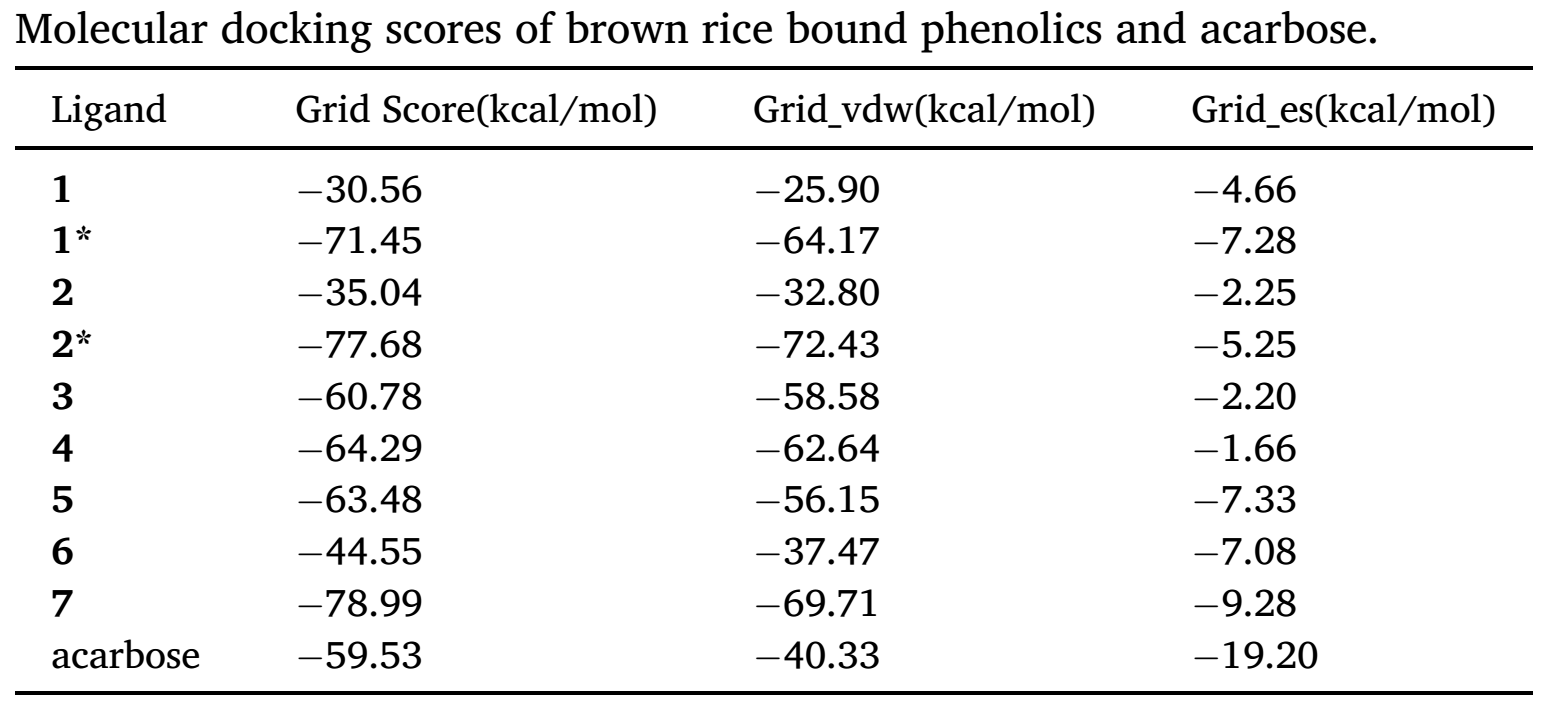
常规对接是一分子配体与一分子受体结合。 但化合物1和2(单体)的对接打分较高,化合物7的对接打分最低,作用力最强,与实验观察不一致。研究者认为化合物1和2的分子结构相对较小,与α-葡萄糖苷酶的接触面积较小,疏水相互作用较弱,所以对接打分较高,而化合物7相当于化合物2的三聚体,结合力自然更强。
因此,研究者推测α-葡萄糖苷酶在结合过程中可能同时与化合物1或2的三个分子结合。经过尝试,研究人员将三个化合物分子逐一对接到α-葡萄糖苷酶的口袋中,以三聚体(加*标记)而非单体作为配体进行对接打分和结合模式分析。
结果表明,化合物1 * (−71.45 kcal/mol)和化合物 2 * (−77.68 kcal/mol)的对接打分都低于阳性对照阿卡波糖(−59.53 kcal/mol),与实验观察到的抑制活性结果相一致。
除了疏水作用力外,研究人员还发现配体与α-葡萄糖苷酶形成氢键和盐桥(离子键)等非共价键。7种酚酸通过形成1-5个氢键、1-8个疏水相互作用力和2-5个离子键固定在α-葡萄糖苷酶的结合口袋中(图1)。酚酸和α-葡萄糖苷酶结合的时候,大部分都与氨基酸残基ASP349、ARG439、PHE177、ARG312和HIS279发生相互作用。因此疏水作用力、氢键和离子相互作用导致了糙米中的酚类物质对α-葡萄糖苷酶的抑制作用,其中疏水作用起主导作用。
2. 分子动力学
研究人员挑选出对α-葡萄糖苷酶具有最强抑制活性的化合物4、7复合物和α-葡萄糖苷酶游离体(未结合),运用动力学模拟,通过蛋白质骨架的均方根偏差(RMSD)、均方根波动(RMSF)和旋转半径(Rg) 分析了复合体系的动态稳定性和结构变化。结果显示,这三个化合物体系的RMSD值都在1.45Å左右波动,表明体系相对稳定(图2A)。
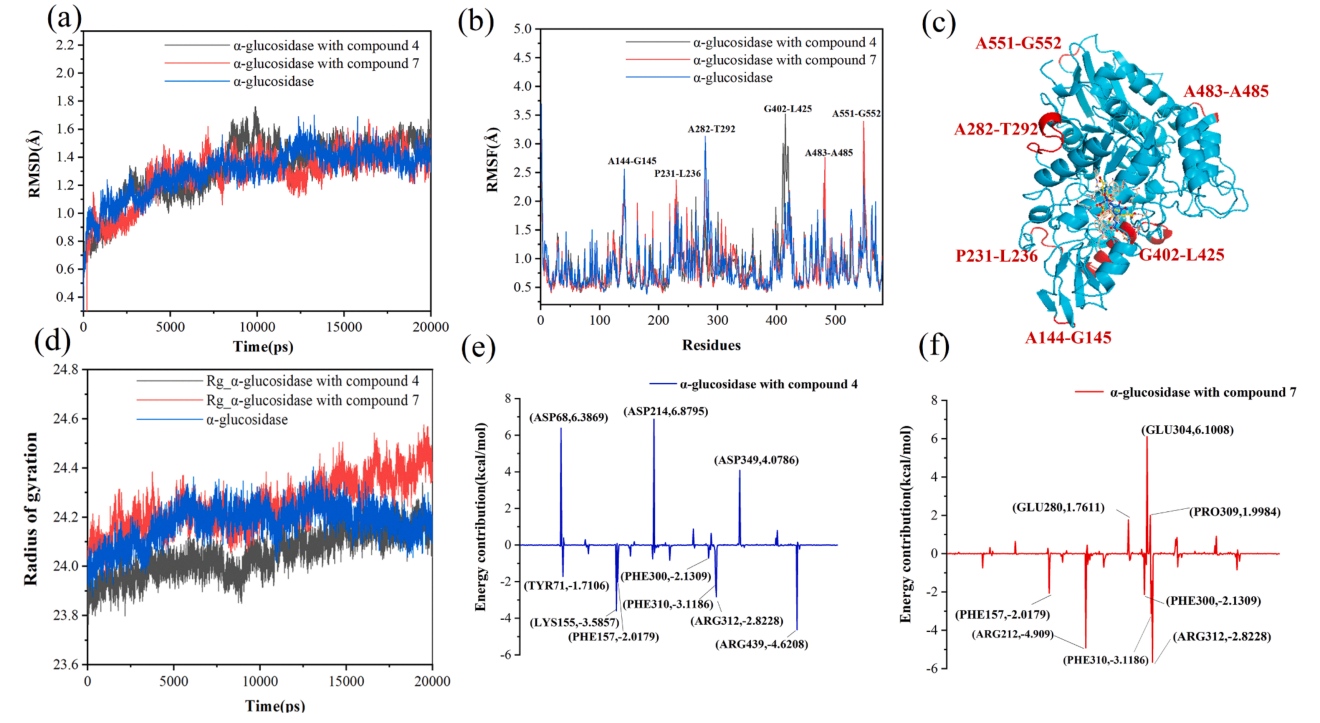
大多数残基的RMSF值相似(即每个残基的内部柔韧性相似),均小于2Å,这表明这些残基具有相对稳定的结构(图2B)。与游离的α-葡萄糖苷酶相比,化合物4结合时α-葡萄糖苷酶残基GLU402-LYS425的RMSF值有较大的波动,化合物7结合时残基PHE231-LYS236、ARG483-ASP485、ARG551-GLU552的RMSF值也高于游离酶。这些结果表明,这些氨基残基更具柔性,这些区域可能在蛋白质执行某些功能方面发挥了作用。
回转半径(Rg)用于描述体系原子沿着特定轴向的分布特征,可用于表征分子的紧密程度(Compactness)。Rg值越小,蛋白质结构越稳定。 化合物4和7结合时的回转半径分别比游离α-葡萄糖苷酶低和高。较小的Rg值表明化合物4与α-葡萄糖苷酶结合并形成更稳定的体系(图2D),因此显示出显著的强抑制活性。较高的Rg值表明化合物7与α-葡萄糖苷酶的复合体的结构更疏松(图2D),这与化合物7具有相对较高的聚合度或较大的分子量有关。虽然化合物7与α-葡萄糖苷酶结合,形成一个不太紧密的体系,但它的抑制活性比化合物4高。
研究者推测,化合物7的高聚合度往往会产生更大的构象灵活性,使α-葡萄糖苷酶能够进入更多的多酚络合部位,从而产生强大的抑制作用。(编者按:抑制活性并不单一取决于酶结构的松紧程度。化合物4结构较小,与酶的接触面积较小、作用力较少,结合力自然较弱;化合物7结构较大,结合力更强,且具有更多可旋转键,故柔性更强,更能适应酶口袋形状。)
对于化合物4与α-葡萄糖苷酶的复合物,残基ASP68、ASP214和ASP349的能量贡献为正,表明这些残基可能阻碍了结合过程。残基LYS155、ARG312、ARG349显示出较低的负值,可能促进结合作用(图2e,f)。类似地,GLU280、GLU304、PRO309残基阻碍了化合物7与α-葡萄糖苷酶的结合,而残基PHE157、ARG212、PHE300、PHE310和ARG312促进了结合过程。结合先前的对接图结果可以看出,这些残基与这两个抑制剂结合,通过分子间作用力形成疏水相互作用或盐桥。这表明它们是BRBPE与α-葡萄糖苷酶结合的关键残基,发挥强抑制作用效果。
案例总结
在这项研究中,研究人员从糙米提取物中筛选出了7种对α-葡萄糖苷酶具有抑制作用的酚类化合物。研究者在殷赋云平台,运用分子对接计算方案分析了酚类化合物与酶之间的相互作用力,包括氢键、疏水力和离子键。进一步应用分子动力学模拟探索了酚类-葡萄糖苷酶复合物的结构特征和分子性质。这项工作为糙米结合态酚类化合物作为有效的α-葡萄糖苷酶抑制剂提供了深刻的见解。该成果发表在 《Food Chemistry》上。
REFERENCE
Caiyan Ye, Ruifen Zhang, Limei Dong, Jianwei Chi, Fei Huang, Lihong Dong, Mingwei Zhang, Xuchao Jia. α-Glucosidase inhibitors from brown rice bound phenolics extracts (BRBPE): Identification and mechanism. Food Chemistry 2021 Oct 5. DOI: 10.1016/j.foodchem.2021.131306 (IF: 7.514)
